D-Glutaminezuur CAS: 6893-26-1 99% Wyt poeder
| Katalogusnûmer | XD90313 |
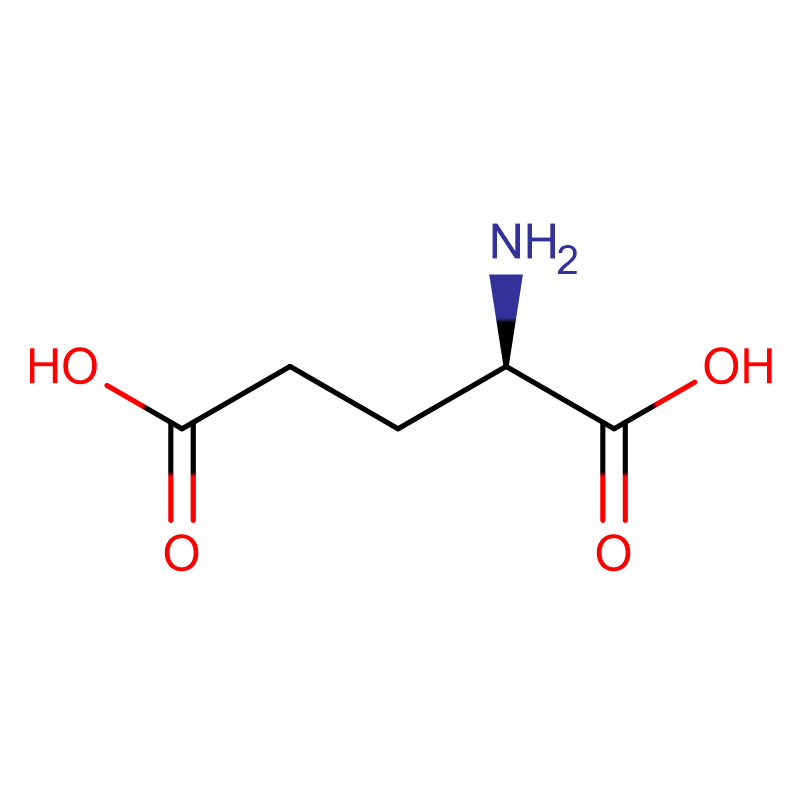
| Produkt Namme | D-Glutaminezuur |
| CAS | 6893-26-1 |
| Molekulêre formule | C5H9NO4 |
| Molekuul gewicht | 147.13 |
| Storage Details | Ambient |
| Harmonisearre tariefkoade | 29224200 |
Produkt Spesifikaasje
| Ferskining | Wite kristallijn poeder |
| Assay | 99% |
| Spesifike rotaasje | -31 oan -32,2 |
| Swiere metalen | <10ppm |
| AS | <1ppm |
| pH | 3 - 3,5 |
| SO4 | <0.020% |
| Fe | <10ppm |
| Ferlies op Drying | <0.20% |
| Residu op Ignition | <0.10% |
| NH4 | <0.02% |
| Cl | <0.02% |
| Steat fan oplossing | >98% |
γ-Glutamyltranspeptidasen (γ-GT's) splitje de γ-glutamylamide-bân fan glutathione en ferpleatse de frijjûne γ-glutamylgroep nei wetter (hydrolyse) of akseptoraminosoeren (transpeptidaasje).Dizze ubiquitous enzymen spylje in wichtige rol yn 'e biosynteze en degradaasje fan glutathione, en yn xenobiotyske detoxifikaasje.Hjir melde wy de 3Å resolúsje kristalstruktuer fan Bacillus licheniformis γ-GT (BlGT) en dy fan syn kompleks mei l-Glu.Röntgenstruktueren befêstigje dat BlGT heart ta de N-terminale nukleofile hydrolase-superfamylje en litte sjen dat it aaiwyt in iepene aktive side-kloof hat fergelykber mei dat rapportearre foar it homolooch enzyme fan Bacillus subtilis, mar oars as dy waarnommen foar minsklike γ-GT en foar γ-GT's fan oare mikroorganismen.Gegevens suggerearje dat de bining fan l-Glu in weryndieling fan 'e C-terminale sturt fan BlGT grutte subunit feroarsaket en de identifikaasje fan in kluster fan soere residuen mooglik makket dy't potinsjeel belutsen binne by de erkenning fan in metaalion.De rol fan dizze resten op 'e konformaasjestabiliteit fan BlGT is studearre troch it karakterisearjen fan de autoferwurking, enzymatyske aktiviteit, gemyske en thermyske denaturaasje fan fjouwer nije Ala single mutanten.De resultaten litte sjen dat ferfanging fan Asp568 mei in Ala ynfloed hat op sawol de autoferwurking as de strukturele stabiliteit fan it proteïne.